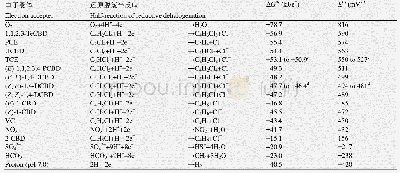
《表2 固态电解质材料的电化学窗口以及在氧化、还原电位下的相平衡产物[56]》
此外,Zhu等[56–57]采用第一性原理计算了锂离子固态电解质材料的电化学稳定性。计算结果表明,普通固体电解质材料的电化学窗口均比较窄,硫化物固态电解质的电压窗口更窄(图14a),氧化分解电压约在2.0~2.5 V之间,还原分解电压约为1.7 V。作者认为[56]实验上观测到的较优异的电化学稳定性并不是材料本身固有的热力学性能,而是源于动力学原因:材料分解反应迟滞的动力学因素导致过电位较高,使得实验上观测到的电化学窗口较宽。电解质分解产物在电解质和电极的界面处形成一层钝化层,类似于液体电池体系中的固态电解质膜(SEI),防止固态电解质发生进一步的分解反应。表2[56]列出了不同锂离子固体电解质材料的电化学稳定窗口以及在各自还原和氧化电位下的相平衡产物。例如Li3PS4和Li7P2S8I的还原分解产物包含Li的二元化合物Li2S和LiI,这些产物在较高的Li化学势μLi下也很稳定(图14a),该稳定电位低于电解质本身的还原电位(图14b)。作者阐明了“界面钝化层”作用机制[56]:在平衡态,由于电极和电解质界面处的电压降会使得界面处Li+离子和其他电荷载体(例如电子e–)重新分布,快速移动的Li+离子的电化学势μ?Li+(包含静电势能)在穿过界面处保持不变。然而,如果界面钝化层分解相的电子电导非常差,电子无法在该层内自由移动,电子的电化学势μ?e-从负极到电解质时会显著降低。因此,Li的化学势(μLi=μ?Li++μ?e-)从负极穿过界面到电解质层后也会降低。界面钝化层的存在使得Li的化学势μLi降低到电解质本身的电化学稳定电压窗口以内,因此固态电解质内没有足够的热力学驱动力使得体相进一步发生分解,从而达到了提高电化学稳定性的目的。
| 图表编号 | XD0088664500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.01 |
| 作者 | 刘丽露、吴凡、李泓、陈立泉 |
| 绘制单位 | 天目湖先进储能技术研究院、天目湖先进储能技术研究院、中国科学院物理研究所长三角研究中心、中国科学院物理研究所清洁能源实验室、天目湖先进储能技术研究院、中国科学院物理研究所长三角研究中心、中国科学院物理研究所清洁能源实验室、天目湖先进储能技术研究院、中国科学院物理研究所长三角研究中心、中国科学院物理研究所清洁能源实验室 |
| 更多格式 | 高清、无水印(增值服务) |
![《表2 固态电解质材料的电化学窗口以及在氧化、还原电位下的相平衡产物[56]》](http://bookimg.mtoou.info/tubiao/gif/GXYB201910005_04700.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式