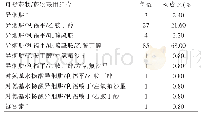
《表2 2 0 1 4 年至2016年ADR报告类型及构成比[例 (%) ]》
报告类型:由表2可见,2014年和2015年均无新的、严重的ADR报告,但随着监测工作的深入开展,以及医务人员安全意识的提高,2016年有7例新的、严重的ADR上报,涉及药品为重组人粒细胞刺激因子(3例)、伊达比星(2例)、利妥昔单抗(1例)和培门冬酶(1例)。新的和严重的ADR报告占比为27.13%,基本和2014年至2016年《国家药品不良反应监测年度报告》的平均水平27.83%保持一致,说明我院评价、上报工作比较稳定,但仍有上升空间。共有38例严重ADR报告,无死亡病例报告,且均经对症治疗后好转。通过分析影响不良反应的因素,采取针对性的预防措施,可有效减少或避免ADR发生[5]。近年来,我院药品安全性监测管理小组采取系列措施加大对严重ADR的上报力度,除对上报人给予一定的物质奖励,在临床科室宣教外,还组织临床药师开展病例讨论,并将讨论结果反馈给上报人;每月整理分析上报的严重ADR并发布到医院内网上,提高临床对ADR上报的积极性,降低ADR漏报情况及发生率。
| 图表编号 | XD0081598100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.05 |
| 作者 | 吴菲、沈爱宗、李民 |
| 绘制单位 | 中国科学技术大学附属第一医院·安徽省立医院药剂科、中国科学技术大学附属第一医院·安徽省立医院药剂科、中国科学技术大学附属第一医院·安徽省立医院药剂科 |
| 更多格式 | 高清、无水印(增值服务) |
![《表2 2 0 1 4 年至2016年ADR报告类型及构成比[例 (%) ]》](http://bookimg.mtoou.info/tubiao/gif/YYGZ201917030_01000.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

![表6:ADR报告类型分布及构成比[n(%),n=1 507]](http://bookimg.mtoou.info/tubiao/gif/ZGCF202004037_02200.gif)

![表2 宝山区2007-2016年不同年龄组儿童意外死亡原因及构成比[例(%)]](http://bookimg.mtoou.info/tubiao/gif/ZFYB202004002_02100.gif)