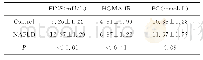
《表3 细胞模型建立糖代谢检测指标》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《HepG2糖脂紊乱模型构建与红曲紫薯提取物体外糖脂代谢干预评价》
注:*表示与25G 1%BSA比有显著性差异,P<0.05。
细胞模型构建具体结果见表3及表4,用不同浓度OA的诱导液诱导HepG2细胞24 h后,各组出现了细胞葡萄糖摄取量和细胞内糖原含量下降、细胞内TG含量上升的趋势,说明HepG2细胞出现不同程度的糖脂代谢紊乱。2OA组TG含量明显高于1OA组,说明OA改变HepG2细胞的脂肪酸代谢,细胞内TG累积显著增加,推测OA通过干扰HepG2胰岛素受体底物的磷酸化加剧了肝脏IR[17]。果糖可以最终转化为葡萄糖、脂肪酸和脂质,促进脂质从头合成,但25F组糖脂代谢紊乱程度小于15F组,可能是25 mmol/L果糖浓度过高,不适用于HepG2细胞糖脂代谢紊乱模型构建。20G 15F 1OA组与20G 15F 2OA组的葡萄糖吸收量显著降低(P<0.05),均可作为糖脂代谢紊乱模型进行后续实验。由于高OA的诱导液易析出沉淀,不易存放,故采用20G 15F 1OA作为后续实验用诱导液。
| 图表编号 | XD0041407700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.20 |
| 作者 | 周文萱、柳嘉、潘聪、田巧基、刘义凤、李耀、赵吉兴、段盛林 |
| 绘制单位 | 中国食品发酵工业研究院有限公司功能主食创制与慢病营养干预北京市重点实验室、中国食品发酵工业研究院有限公司功能主食创制与慢病营养干预北京市重点实验室、吉林农业大学、中国食品发酵工业研究院有限公司功能主食创制与慢病营养干预北京市重点实验室、中国食品发酵工业研究院有限公司功能主食创制与慢病营养干预北京市重点实验室、山东中惠生物科技股份有限公司、山东中惠生物科技股份有限公司、中国食品发酵工业研究院有限公司功能主食创制与慢病营养干预北京市重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |