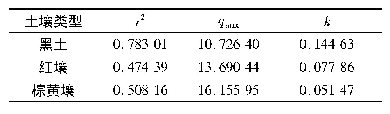
《表2 γ-AlOOH@SiO2/Fe3O4吸附Cu2+的动力学方程及参数》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《磁性羟基氧化铝的制备及对水体中Cu~(2+)的吸附性能研究》
注:1) Qt为t时吸附量,mg/g;Kp为内扩散速率常数,mg/(g·min1/2);t为接触时间,min。
对吸附过程进行动力学分析,相关参数见表2。准一级反应动力学模型的R2较低(0.711 8),Qm模拟值(15.11 mg/g)与实验值(49.18 mg/g)相差太大,说明准一级反应动力学方程不适合用于描述γ-AlOOH@SiO2/Fe3O4吸附水体中的Cu2+。准二级反应动力学模型的R2较高(0.998 3),Qm模拟值(50.51mg/g)与实验值接近,表明准二级反应动力学方程适合用于描述γ-AlOOH@SiO2/Fe3O4吸附水体中的Cu2+,同时也说明该吸附过程为化学吸附[21],该结论与前述热力学分析结果一致。吕双[22]指出,Fe3O4/TiO2比表面积为32.21m2/g,其对Cu2+的去除率为70%,该吸附过程为物理吸附。本研究中γ-AlOOH@SiO2/Fe3O4比表面积为26.53m2/g,对Cu2+的去除率高达95%以上,该吸附过程为化学吸附,不同的吸附机理解释了低的比表面积但拥有较高的去除率。通常采用粒子内扩散方程(见式 (5)) 来探讨吸附过程的限速步骤。吸附初始阶段是快速的外扩散和表面吸附,这个过程大概在30min内完成;第2阶段是由内表面扩散和孔扩散所引起的,被吸附的Cu2+沿着吸附剂的孔壁进一步向内部扩散,一部分Cu2+沿着孔道向内部扩散,在此过程中逐渐被吸附,由于材料本身的多孔结构不利于Cu2+快速扩散到孔结构的内部,因此这个过程相当缓慢;第3阶段是最终平衡阶段,在此阶段粒子内扩散速率减慢并最终达到平衡,Kp接近0mg/(g·min1/2)。前两个阶段的Kp分别为11.566 0、0.268 9mg/(g·min1/2),这也说明外扩散和表面吸附过程迅速,而内扩散速率相当缓慢。
| 图表编号 | XD0025433500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.10.01 |
| 作者 | 罗琨、庞娅、李雪、廖兴盛、雷敏、刘运红 |
| 绘制单位 | 长沙学院生物与环境工程院、长沙学院生物与环境工程院、长沙学院生物与环境工程院、长沙学院生物与环境工程院、长沙学院生物与环境工程院、长沙学院生物与环境工程院 |
| 更多格式 | 高清、无水印(增值服务) |