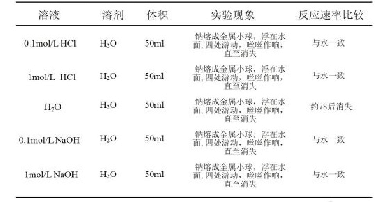
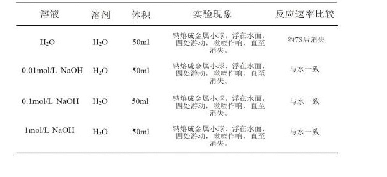
《表1 溴丁烷和氰化钠的取代反应在不同溶剂中的相对反应速率[10]》
式中,k?是本征反应速率常数,Δk是反应微环境及其结构演化对反应速率常数的影响。因此可通过改变微环境调控Δk,从而提高反应速率。如表1所示,在溴丁烷和氰化钠的取代反应C4H9Br+Na CN????C4H9CN+Na Br中,溶剂发挥着重要的调控作用[10]:溴丁烷和氰化钠可以发生取代反应,但是如果反应溶剂为甲醇和水时,反应虽可以进行,但反应速率很慢,产率低。若采用二甲基亚砜、二甲基甲酰胺和乙腈作反应溶剂时,其反应速率比以甲醇作溶剂时分别快1300、2800和5000倍。从反应-传递耦合的观点来看,化学反应速率还与反应底物浓度、分子扩散速率和催化剂种类、结构和形貌等因素密切相关。而反应溶剂特性既决定了反应底物分子的饱和溶解浓度,也影响了其扩散速率,进而影响反应-分子传递耦合的匹配程度,此外,反应溶剂流动速率还影响产物分子的界面脱附、传递及反应平衡走向等。以双氧水的绿色制备为例,氢气和氧气通过催化反应生成双氧水,被视为现行蒽醌法合成技术的绿色替代路线,具有重要战略意义和应用价值,受到学术界和工业界的广泛关注。人们开发了多种高活性双金属催化剂,但受制于双氧水反应强放热特性,该项技术研发陷入了“活性越高越易爆炸”怪圈。分析表明,采用纳微反应器并选择合适的溶剂,可降低催化位点附近反应底物浓度并调控反应-传递匹配程度,从而有效规避爆炸风险,并稳定提高反应的选择性和转化率。
| 图表编号 | XD00197940100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.01 |
| 作者 | 唐伟强、谢鹏、徐小飞、赵双良 |
| 绘制单位 | 华东理工大学化学工程联合国家重点实验室、广西大学化学化工学院广西石化资源加工及过程强化技术重点实验室、华东理工大学化学工程联合国家重点实验室、华东理工大学化学工程联合国家重点实验室、广西大学化学化工学院广西石化资源加工及过程强化技术重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
![《表1 溴丁烷和氰化钠的取代反应在不同溶剂中的相对反应速率[10]》](http://bookimg.mtoou.info/tubiao/gif/HGSZ202102001_00800.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式