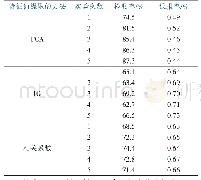
《表1 4类滴定分析方法的比较》
滴定分析又称容量分析,是定量化学分析的核心内容。学完了4种滴定分析方法,通过比较它们的相同和不同之处,可以对所学的知识理解得更深刻,使学习的效果更好[3]。4类滴定分析方法是在4大平衡理论基础上建立起来的,化学平衡原理是共性,因此,4类滴定分析方法在内容上有许多相似之处,如:化学反应平衡,滴定曲线,突跃范围及其影响因素,准确滴定及分步滴定的判据,指示剂的选择,终点误差公式等(详见表1)。根据路易斯酸碱理论,络合反应、沉淀反应及氧化还原反应都可看成酸碱反应,它们完全统一在同一事物的本质之中。因此,在学习这4种滴定分析方法时,首先要根据滴定反应的平衡常数和待测物质的浓度判断待测物质是否可以被准确滴定,有几个滴定突跃;接下来绘制滴定曲线,分析突跃范围的大小,讨论影响突跃范围的因素;然后根据突跃范围和化学计量点选择合适的指示剂;最后就是根据滴定终点与化学计量点的差距计算滴定误差。但是,相似之中又存在不同之处,比如在酸碱滴定、络合滴定和沉淀滴定中,化学计量点都位于突跃范围的正中央,影响突跃范围的因素都可以归结为2个因素(被滴定物质的总浓度及滴定反应的平衡常数),而在氧化还原滴定中只有当2个电对的电子转移数目相等时,化学计量点才位于突跃范围的正中央,影响突跃范围的因素只有滴定反应的平衡常数。此外,酸碱平衡、络合平衡、氧化还原平衡及沉淀溶解平衡又是共性制约下的个性[5]。因此,每一种滴定分析方法又有着自己独特的个性,如酸碱滴定中溶液pH的计算、络合滴定中的酸度控制及提高选择性的途径、氧化还原滴定前的预处理过程、沉淀滴定中实验条件的选择等。
| 图表编号 | XD0018793200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.11.18 |
| 作者 | 李爱峰、王术皓、贾文丽、薛庆旺 |
| 绘制单位 | 聊城大学化学化工学院、聊城大学化学化工学院、聊城大学化学化工学院、聊城大学化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式