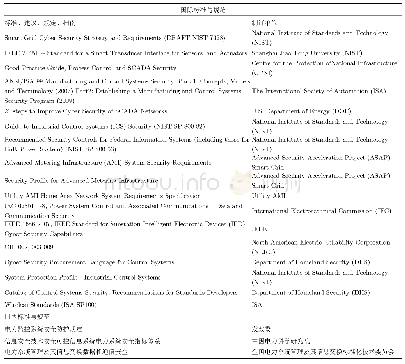
《表1 国内外现有药包材洁净环境检测用法规/标准》
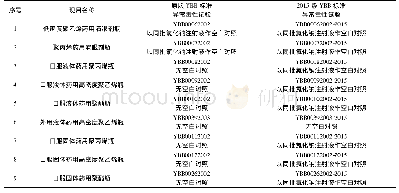
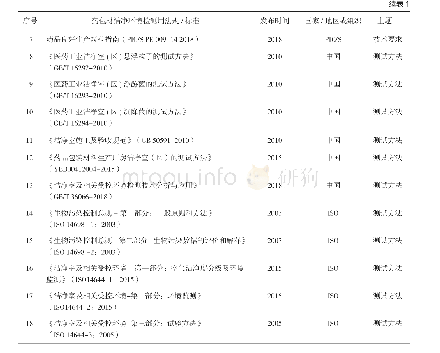
由于药包材生产洁净环境的重要性,多个国家和组织都针对药包材洁净环境发布了法规和相应标准,目前国内外现有的药包材洁净环境标准见表1。我国最早的相关规定是2004年原国家食品药品监督管理局公布的《直接接触药品的包装材料和容器管理办法》(局令第13号)[1]。2010年,国家发布了《洁净室施工及验收规范》(GB50591-2010)[8],明确了洁净室施工和验收相关标准要求。另有《医药工业洁净室(区)悬浮粒子的测试方法》(GB/T 16292-2010)、《医药工业洁净室(区)浮游菌的测试方法》(GB/T 16293-2010)和《医药工业洁净室(区)沉降菌的测试方法》(GB/T 16294-2010),分别对洁净环境中悬浮粒子、浮游菌和沉降菌的测试方法作了具体规定[9-11]。《药品生产质量管理规范》[12](GMP)及其《附录1无菌药品》于2010年进行了修订,内容上基本实现与国际先进法规和标准的接轨。2015年,中国食品药品检定研究院发布了《国家药包材标准》,其中有《药品包装材料生产厂房洁净室(区)的测试方法》(YBB00412004-2015)[4],对药包材生产厂房洁净室各项目的具体测试方法进行了规定。2018年,我国发布了《洁净室及相关受控环境检测技术分析与应用》(GB36066-2018)[13],对洁净室及相关受控环境的检测要求、基本仪器配置和技术要求进行了规定。欧盟、美国、日本和澳大利亚等国也有各自的GMP出台[14-20],国际药品认证合作组织(Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme,PIC/S)GMP[15]是目前全球公认最严谨的制药规范,在2018年6月发布了其修订后的最新版本。国际标准化组织(International Organization for Standardization,ISO)在《洁净室及相关受控环境》(ISO 14644 2005)[21-23]和《生物污染控制总则》(ISO 14698 2003)[24-25]中对洁净环境部分参数的测试方法也有体现。
| 图表编号 | XD00127793600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.20 |
| 作者 | 田霖、杨会英、孙会敏 |
| 绘制单位 | 中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式