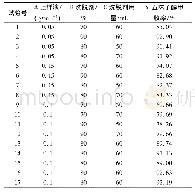
《表2 重组Mi Man蛋白的纯化结果Tab.2 Purification result of recombinant protein Mi Man》
将甘露糖苷酶表达菌株BL21(DE3)-pET-MiMan种子液按1∶100转接于含30μg/mL卡那霉素的LB培养基,培养至OD600为0.6~0.8后加入终浓度0.5μmol/L的IPTG,于16℃、200r/min培养20h。离心弃上清之后进行超声细胞破碎,获得粗酶液。利用Ni Sepharose 6Fast Flow亲和填料和DEAE对目的蛋白Mi Man进行纯化。SDS-PAGE电泳结果如图4所示,Mi Man在大肠杆菌中能够高水平的可溶性表达。经纯化后,杂蛋白被有效去除,获得纯度大于90%的目的蛋白。如表2和图4所示,目的蛋白Mi Man分子质量约为110ku。质量浓度为0.23mg/mL,回收率为8.96%,相对酶活为0.224U/mg。
| 图表编号 | XD0015399800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.09.01 |
| 作者 | 杨帆、李鹤、杨兰、李宪臻 |
| 绘制单位 | 大连工业大学生物工程学院、大连工业大学生物工程学院、大连工业大学生物工程学院、大连工业大学生物工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

![表3 重组人骨形态发生蛋白2(recombinant human bone morphogenetic protein,rhBMP-2)相关不良反应总结[34]](http://bookimg.mtoou.info/tubiao/gif/LCKY202003016_04100.gif)