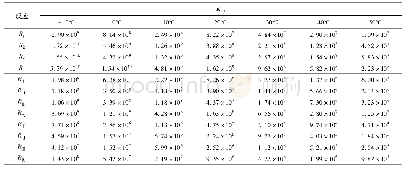
《表3 离子强度为0、温度为25℃时各反应式及其相应的平衡常数[18]》
当锌表面沉积MgCl2时,XRD检测表明其表面的腐蚀产物仅为Zn5(OH)8Cl2·H2O,说明MgCl2能抑制Zn4CO3(OH)6·H2O和Zn(OH)2的生成。图6给出了锌二价腐蚀产物在4 mol·L-1的Cl-离子溶液中腐蚀产物的优势区图,其中温度为25℃、大气压强为1.013×105Pa,空气中CO2浓度为350×10-6,Cl-离子浓度值是根据MgCl2溶液在80%RH时的理论平衡Cl-离子浓度设置的[21]。图中用腐蚀产物Zn5(CO3)2(OH)6替代了Zn4CO3(OH)6·H2O,因为后者是前者的亚稳相,随着时间的延长后者转化为前者[18]。表3给出了优势区图计算过程中使用到的反应式及其相应的平衡常数。从图6可见,腐蚀产物Zn5(CO3)2(OH)6的pH值比Zn5(OH)8Cl2·H2O的高,生成区间位于pH值8到11之间。因此可以认为,本文实验中的腐蚀产物Zn4CO3(OH)6·H2O更倾向于生成在锌大气腐蚀时的阴极区,而腐蚀产物Zn5(OH)8Cl2·H2O更倾向于生成在锌大气腐蚀时的阳极区。而MgCl2液膜中的Mg2+离子易与OH-离子结合生成Mg(OH)2沉淀(方程9)降低液膜的pH值[8,18,22],从而抑制了腐蚀产物Zn4CO3(OH)6·H2O的生成。同时,pH值的下降促进了腐蚀产物Zn5(OH)8Cl2·H2O的生成。因此,在Mg1组和Mg2组锌表面只检测到腐蚀产物Zn5(OH)8Cl2·H2O。
| 图表编号 | XD0085218200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.25 |
| 作者 | 尹奇、刘淼然、刘雨薇、潘晨、王振尧 |
| 绘制单位 | 中国科学院金属研究所、中国科学技术大学材料科学与工程学院、中国科学院金属研究所、中国科学院大学、中国科学院金属研究所、中国科学院金属研究所、中国科学院金属研究所 |
| 更多格式 | 高清、无水印(增值服务) |
![《表3 离子强度为0、温度为25℃时各反应式及其相应的平衡常数[18]》](http://bookimg.mtoou.info/tubiao/gif/CYJB201909009_05700.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式