《表1 离子吸附速率方程中相关参数》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
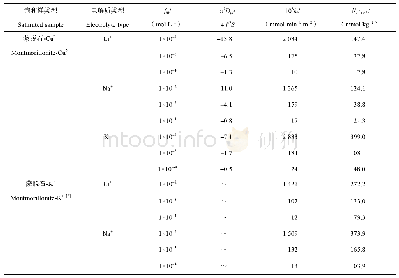
《碱金属离子在蒙脱石-Cu~(2+)表面吸附的离子特异性》
注:fi0表示电解质浓度;π2Dpi(4 l'2S)–1表示速率方程的斜率;ki表示i离子动力学吸附速率;Ni(eq)表示离子平衡吸附量。下同Note:fi0 stands for electrolyte concentration;π2Dpi(4 l'2S)–1 for slope of the rate equation;ki for kinetic adsorption rate;and Ni(eq
为了直接利用实验数据,将动力学方程写成差分形式,并直接利用动力学实验数据可得到d Ni(t)/dt vs.Ni(t)间的关系,结果如图3所示。同时根据图3所获得的吸附动力学参数结果列于表1中,由图3和表1可以看出:(1)不同浓度条件下的碱金属离子K+、Na+和Li+在交换Cu2+时均呈现出一级动力学特征,说明该条件下碱金属离子K+、Na+和Li+在蒙脱石-Cu2+表面下的吸附为弱静电力作用下的吸附。D u等[9]提出强极化离子的吸附将在吸附初期表现出零级速率特征,而后变为一级速率特征,但是弱极化离子仅表现出一级速率特征,并且吸附动力学过程中存在的离子特异性效应用Hofmeister能wH(0)来定量描述,离子的wH(0)较高时,在吸附初期会出现零级动力学过程,随后再转化为一级动力学过程;反之,wH(0)较低时,吸附仅出现一级动力学过程。由此可推测本实验体系中K+、Na+和Li+的Hofmeister能wH(0)相比Cu2+的均较低。(2)相同电解质浓度条件下K+、Na+和Li+的吸附动力学速率和平衡吸附量均存在离子特异性效应,并且电解质浓度影响离子的吸附选择性顺序,例如,电解质浓度为0.000 1 mol·L–1与0.001 mol·L–1时平衡吸附量表现为K+>>Na+>Li+;当浓度升高至0.01 mol·L–1时,平衡吸附量则呈现为K+>>Li+>Na+,表明在较高浓度下离子的体积效应可能对平衡吸附量存在影响。
| 图表编号 | XD00173238400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.01 |
| 作者 | 潘小丽、刘新敏、李航、李睿 |
| 绘制单位 | 西南大学资源环境学院土壤多尺度界面过程与调控重庆市重点实验室、西南大学资源环境学院土壤多尺度界面过程与调控重庆市重点实验室、西南大学资源环境学院土壤多尺度界面过程与调控重庆市重点实验室、西南大学资源环境学院土壤多尺度界面过程与调控重庆市重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |