《表1 化学反应热力学计算》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《NiO在NaCl-KCl-NaF熔盐体系中的溶解度及溶解机理》
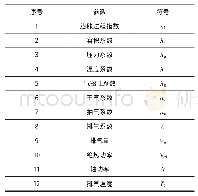
该熔盐体系包括NaCl、KCl、NaF、NiO四种化合物质共有Na、K、F、Cl、Ni、O这六种元素,利用热力学软件HSC进行热力学计算可能存在90多种物质,根据实验温度条件可以排除重复出现的物质和一些单质以及一些不合理价态物质最终推断可能存在的化学反应,结果见表1。根据方程式,使用Factsage7.0热力学软件、HSC6.0热力学软件可以得出在实验温度范围内标准吉布斯自由能(ΔGΘ)随温度的变化曲线,如图6所示。一般判断反应进行方向用ΔG,但ΔG与反应条件有关,很难算出,常用ΔGΘ来判断近似反应方向[8-9]。从图6中可以看出在实验条件下各个反应的ΔGΘ都大于0,说明反应无法正向进行。
| 图表编号 | XD0045749000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.03.25 |
| 作者 | 李孟星、孟祥海、柳亚斌、张宏博、李欣、李运刚 |
| 绘制单位 | 华北理工大学冶金与能源学院、华北理工大学冶金与能源学院、唐山工业职业技术学院、华北理工大学冶金与能源学院、华北理工大学冶金与能源学院、华北理工大学冶金与能源学院、华北理工大学冶金与能源学院 |
| 更多格式 | 高清、无水印(增值服务) |