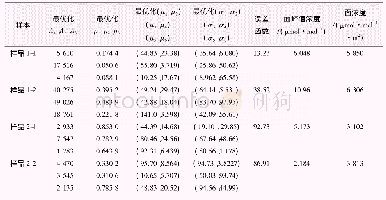
《表2 基于FTIR的BSA及其复合物二级结构分析单位:》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《牛血清蛋白与邻苯二酚、间苯三酚相互作用的机理探究》
与BSA比较,4种复合物在酰胺I和酰胺II带也发生了位移,说明BSA与邻苯二酚、间苯三酚的相互作用伴随着蛋白质二级结构的变化。对酰胺I(1 600~1 700 cm-1)的光谱进行高斯拟合,得到二级结构含量,如表2所示。OP-BSA、OOP-BSA、MP-BSA、OMP-BSA复合物中α-螺旋含量分别降低15.40%、15.60%、16.00%、16.00%,β-折叠分别上升25.60%、28.90%、18.20%、14.00%,β-转角分别上升7.10%、5.90%、7.70%、17.20%,无规则卷曲分别上升5.10%、5.60%、1.20%、3.40%。表明引入氧化和未氧化的OP、MP都会破坏BSA的二级结构,并且OP、OOP对BSA二级结构的影响大于MP、OMP,这与邻苯二酚对BSA一级结构有更大影响相对应。蛋白质中的α-螺旋、β-折叠结构是靠氢键来稳定的,酚类化合物的加入造成蛋白分子内部的氢键发生改变,从而导致BSA二级结构的变化。RAWEL等[25]在探究绿原酸共价结合诱导牛血清白蛋白的结构变化时发现,绿原酸和BSA的反应导致BSAα-螺旋减少,而其余结构增加。JIANG等[43]在研究乳清蛋白分离物(whey protein isolates,WPI)和酪蛋白(casein,CS)与绿原酸非共价相互结合时,发现WPI、CS红外光谱图中酰胺I和酰胺II的移动,并且α-螺旋含量减少,β-折叠含量增加。这些结果与本研究结果一致。
| 图表编号 | XD00170967200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.15 |
| 作者 | 褚千千、艾健、方佳琪、韩秋煜、包斌、孙永军 |
| 绘制单位 | 上海海洋大学食品学院、上海海洋大学食品学院、上海海洋大学食品学院、上海海洋大学食品学院、上海海洋大学食品学院、食品科学与工程国家级实验教学示范中心(上海海洋大学)、好当家集团有限公司 |
| 更多格式 | 高清、无水印(增值服务) |