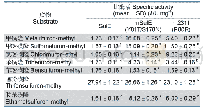
《表2 突变体酶的酶活及比酶活测定》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《点突变提高甲酸脱氢酶(CbFDH)的酶活和催化效率》
注:nd表示没有测量。
按照1.2.2所述方法诱导表达,然后离心收集细胞,用超声破碎仪破碎并离心去除细胞破碎沉淀,破碎上清液即为重组菌表达后的粗酶液。进一步利用镍柱纯化,得到突变体酶和野生型的纯酶样品。所有样品经处理后,进行SDS-PAGE电泳分析,见图3。得到的突变体酶的蛋白质相对分子质量大小为40 300,符合CbFDH利用载体pET28a(+)表达后的大小。同时可以看出,除了V93I,其余突变体酶的蛋白质质量浓度比野生型酶有所下降。进一步对突变体酶的酶活、比酶活及蛋白质质量浓度进行测定,结果见表2。表明突变体酶V93I的体积酶活为19.37 U/mL,比野生型提高34.7%,比酶活为6.39U/mg,相比野生型提高22.6%。突变体酶V93A和V93相比野生型,酶活分别降低66%和92.9%,比酶活分别下降26.1%和79.8%。而V93G已经完全失活,在之后酶学性质研究中将不再涉及。上述结果可以看出,CbFDH酶活随着V93位氨基酸残基疏水性的增强而提高(突变体酶V93L除外),其中V93I的酶活和比酶活均为最高,相比野生型酶更加有优势。
| 图表编号 | XD0059216900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.03.01 |
| 作者 | 郑俊贤、王子渊、杨套伟、张显、徐美娟、饶志明 |
| 绘制单位 | 江南大学生物工程学院、江南大学生物工程学院、江南大学生物工程学院、江南大学生物工程学院、江南大学生物工程学院、江南大学生物工程学院 |
| 更多格式 | 高清、无水印(增值服务) |