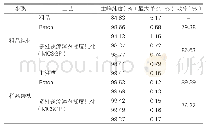
《表1 b SMNE纯化流程中蛋白质质量、比活力、纯度及回收率》
b SMNE重组蛋白质纯化流程见图3 (a),是该表达系统经典的纯化流程之一。对离心后收集的上清液进行色谱层析纯化,利用重组b SMNE上所带的6x His标签,使用Ni2+亲和层析富集上清液中的b SMNE,通过咪唑竞争性洗脱。经Ni2+亲和层析纯化后,重组b SMNE纯度已经达到90%以上(图3(b))。最后对洗脱液富集后再进行凝胶阻滞层析。如图3(c)和表1所示,经凝胶阻滞层析后,b SMNE纯度及比活力并没有明显提高,且回收率有所下降,最终回收率为84%,经Bradford法检测蛋白质质量浓度仅为0.12 mg/m L。上述结果显示:在B.choshinenesis中重组表达SMNE,仅需一步亲和层析就能获得高比活目的蛋白质,纯化流程中的最后一步凝胶阻滞层析可略去。纯化后的b SMNE以商业化酶活定义标准进行酶活测定。将3种商业化Benzonase按其标称酶活梯度稀释后,消化底物,检测实际的260 nm吸光值变化,绘制标准曲线,3种商业化酶的标准曲线基本完全吻合,见图4,可以用来测定酶活。因此,将重组表达的b SMNE梯度稀释后,在相同体系下,检测260 nm吸光值变化,见表2,并与标准曲线比较。经计算b SMNE比活力可达1.3×107U/mg,相较在大肠杆菌系统中表达的商业化酶提高了2~3倍。这一结果证实短短芽孢杆菌B.choshinenesis SP3在表达b SMNE上更具有优势。分析其原因主要有:其一,SMNE本身是一种胞外分泌型核酸酶,因此短短芽孢杆菌表达系统作为一种胞外分泌表达系统,相对胞内表达,更容易使SMNE形成正确的活性构象,更易获得比活力高的蛋白质;其二,本实验使用的表达载体是用芽孢杆菌内源细胞壁蛋白质信号肽取代了SMNE自身来源的信号肽,并使用芽孢杆菌细胞壁蛋白质基因的特异型启动子P2,这样有利于芽孢杆菌进入对数生长期后,外源SMNE基因实现高效转录,从而使SMNE蛋白质在随后较长的稳定期得以大量积累。
| 图表编号 | XD00197612500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.01 |
| 作者 | 龚雪梅、胡艳红、陈银霜、程睿婕、张坤晓 |
| 绘制单位 | 江苏海洋大学江苏省海洋生物资源与环境重点实验室、江苏海洋大学江苏省海洋药物活性分子筛选重点实验室、江苏海洋大学江苏省海洋生物产业技术协同创新中心、江苏海洋大学江苏省海洋生物资源与环境重点实验室、江苏海洋大学江苏省海洋药物活性分子筛选重点实验室、江苏海洋大学江苏省海洋生物产业技术协同创新中心、江苏海洋大学江苏省海洋生物资源与环境重点实验室、江苏海洋大学江苏省海洋药物活性分子筛选重点实验室、江苏海洋大学江苏省海洋生物资源与环境重点实验室、江苏海洋大学江苏省海洋药物活性分子筛选重点实验室、江苏海洋大学江苏省海洋 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式