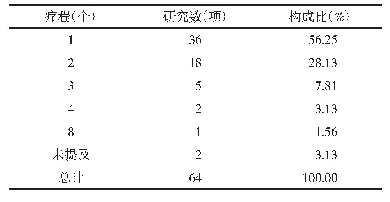
《表1 眼底疾病治疗药物非临床评价考虑》
ICH M3(R2)[15]指导原则指出,批准药物上市所需的非临床安全性试验通常包括安全药理学试验、一般毒性试验、毒代动力学和非临床药动学试验、生殖毒性试验和遗传毒性试验,因存在致癌性担忧的特殊原因或临床上拟长期应用的药物还需进行致癌性试验。根据具体情况具体分析的原则,还应进行其他的非临床试验,以评估光毒性、免疫毒性、幼年动物毒性和依赖性。眼科药物非临床研究中,除了需考虑常规药物的非临床研究内容,还应重点关注眼局部的毒性。对于VEGF抗体等生物技术类药物还应参考ICH S6(R1)[16]指导原则,分阶段开展非临床安全性评价研究(见表1)。
| 图表编号 | XD00161373200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.15 |
| 作者 | 王若男、钱仪敏、宋硕、李华、马璟 |
| 绘制单位 | 中国医药工业研究总院国家上海新药安全评价研究中心上海益诺思生物技术股份有限公司、中国医药工业研究总院国家上海新药安全评价研究中心上海益诺思生物技术股份有限公司、中国医药工业研究总院国家上海新药安全评价研究中心上海益诺思生物技术股份有限公司、中国医药工业研究总院国家上海新药安全评价研究中心上海益诺思生物技术股份有限公司、中国医药工业研究总院国家上海新药安全评价研究中心上海益诺思生物技术股份有限公司 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式