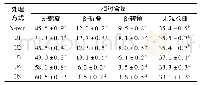
《表1 不同射流空化压力下大豆分离蛋白的二级结构相对含量》
注:同列不同小写字母表示差异显著(P<0.05)。
蛋白质红外光谱酰胺I带(1 700~1 600 cm-1)主要是CO键的伸缩振动和N—H之间的氢键性质,可反映蛋白质的二级结构,是研究蛋白质二级结构的常用方法。根据文献[19]报道,拟合图谱中各子峰与二级结构类型对应关系:1 650~1 660 cm-1为α-螺旋结构,1 618~1 640 cm-1为平行式β-折叠结构,1 670~1 690 cm-1为反平行式β-折叠结构,1 660~1 700 cm-1为β-转角结构,1 640~1 649 cm-1为无规卷曲结构。射流空化辅助提取高温豆粕中大豆分离蛋白的二级结构相对含量分析结果如图2和表1所示,随射流空化处理压力增加,大豆分离蛋白的α-螺旋相对含量呈现减少的趋势,且在1.5 MPa时取得最小值6.34%,β-折叠结构和无规卷曲相对含量呈增加趋势。在0.5~1.5 MPa射流空化压力处理时,空穴效应和机械剪切作用削弱了蛋白质分子间相互作用,导致蛋白质结构延伸和分子排列无序性增加,同时可能会导致蛋白质分子发生解折叠,极性基团暴露,蛋白质构象改变[20]。但当射流空化压力过大时,射流空化产生的高压及极端热等作用加速了蛋白分子运动,增加分子碰撞的可能性,导致一部分蛋白质分子发生聚集,形成难溶性聚集体[21]。结果说明射流空化处理可能使大豆分离蛋白内部氢键结构排列发生改变,大豆分离蛋白构象发生变化,也说明蛋白质由紧凑的分子结构变得更加松散。
| 图表编号 | XD0092339900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.25 |
| 作者 | 李良、周艳、邹智博、郭增旺、吴长玲、王中江 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式