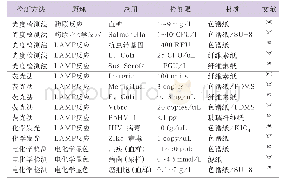
《表1 微流控芯片细胞分离方法比较》
对不同细胞类型进行分类或从异质细胞群体中分离出特定的细胞类型,是生物学研究和疾病诊断中的一个重要环节。常用的微流控芯片细胞分离方法包括荧光激活细胞分选[23]、磁激活细胞分选[24]、物理过滤[25]、介电电泳及声波细胞分选等[26-27],但这些方法都有各自的优点和局限性,见表1。虽然荧光激活细胞分选和磁激活细胞分选是目前细胞分选的金标准,但这2种方法需要对细胞表面进行荧光抗体或磁珠标记,可能改变细胞的功能,影响细胞的后续培养和分析。细胞黏附可作为分离和检测目标细胞的物理标记之一。基于黏附的微流体细胞分选是少数无标记分选技术之一,其不依赖于颗粒的大小,使其成为细胞分选的合适选择。在新的微流控芯片技术中,用功能化的表面捕获靶细胞,据细胞与基质的黏附结合强度来分离细胞,然后在微流体驱动下快速、无损地释放被捕获的靶细胞,实验所需样本量少,无需标记或预处理,分离后的细胞仍具有生物活性,可用于体外培养和后续的研究。多个研究小组证实了这种分离技术在稀有细胞类型分选和富集的实用性。Singh等[28]利用人多功能干细胞与分化细胞之间黏附强度的差异,快速、有效、选择性地分离出完全重编程人多功能干细胞。分离无需标记,存活率大于80%,而荧光激活细胞分选过程中由于流体压力和电场作用的影响,细胞存活率仅为40%。桑维维等[29]构建的MUC1黏蛋白抗体修饰微流控芯片,能有效捕获乳腺癌细胞MDA-MB-231,捕获率达(80±3)%,释放率约98%,细胞释放后存活率高,可实现再培养。Zhang等[30]设计了一种高通量细胞黏附芯片,根据细胞与基质黏附能力的高低,从癌症干细胞中分离和富集2种异质性乳腺癌细胞系SUM-149细胞和SUM-159细胞。Chen等[31]根据正常血细胞和癌细胞对纳米粗化蚀刻玻璃基底的黏附差异,用微流控芯片从全血样本中捕获循环肿瘤细胞的效率高达80%。这种基于黏附的捕获方式,与循环肿瘤细胞表面标志物的表达情况和转移倾向无关,具有收集整个循环肿瘤细胞群体的潜力。Dasanna等[32]根据疟疾感染的红细胞的黏附特性,在微流控芯片内进行细胞黏附动力学模拟,表明可通过优化流体剪切速率和通道的倾斜角度,从受感染患者的血液中分离出疟疾感染的红细胞。
| 图表编号 | XD0078792500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.08 |
| 作者 | 专行、郑国侠、王云华 |
| 绘制单位 | 大连大学医学院、大连大学环境与化学工程学院、大连大学医学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式