《表1 SPI对MPI凝胶最大变性温度的影响》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《预热处理大豆蛋白对鲤鱼肌原纤维蛋白凝胶和流变学特性的影响》
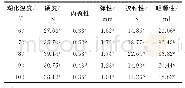
注:同列不同字母表示差异显著(P<0.05)。—.无吸收峰。
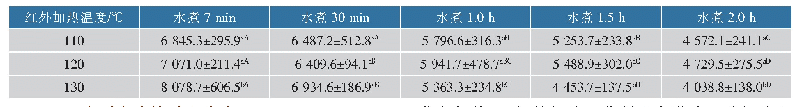
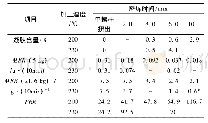
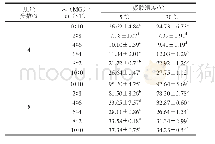
DSC技术适用于研究蛋白质的热变性[3 3]。如图5及表1所示,纯MPI的DSC扫描图谱呈现3个主要峰值记为Tmax1(53.15℃)、Tmax2(63.48℃)和Tmax3(73.95℃),分别代表肌球蛋白重链、肌球蛋白轻链和肌动蛋白热变性温度。MPI中加入天然SPI后,Tmax1并没有显著改变(P>0.05);而加入热处理30 min和180 min的SPI后,Tmax1显著降低(P<0.05)。这可能是由于天然SPI与MPI之间不发生交联,而SPI分别热处理30 min和180 min后与肌球蛋白头部发生交联导致MPI凝胶热稳定性显著降低[34]。此外MPI中加入天然SPI后其DSC扫描图谱呈现4个主要峰值Tmax1(53.30℃)、Tmax2(63.54℃)、Tmax3(71.60℃)和Tmax4(92.73℃),由图5可知,天然SPI组与纯MPI及热处理SPI组相比Tmax3峰较宽。这是由于7S和11S组分的变性温度分别在73~82℃和76~96℃之间[3],结合流变结果添加天然SPI后第1个峰值延后2~4℃可知,7S组分与肌动蛋白热变性温度较接近从而造成添加天然SPI组Tmax3峰较宽,而Tmax4对应SPI中11S组分变性温度。综合以上两点可知在混合蛋白中天然SPI与MPI分别独立存在。
| 图表编号 | XD0075145800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.25 |
| 作者 | 杜洪振、陈倩、杨振、孙钦秀、孔保华 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |