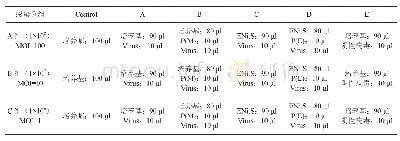
《表2 感染实验分组和感染条件》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《利用慢病毒载体建立fractalkine基因敲低的HK-2稳定细胞株》
通过感染预实验确定慢病毒载体对HK-2细胞株的最佳感染条件(细胞数量、感染试剂、感染后换液时间等)和感染复数(MOI)。实验分组及具体操作步骤如下:(1)合适感染条件确定:为了确认合适的感染条件,按照不同培养条件将实验分为5组:常规培养基组(A组),观察常规培养条件下病毒对细胞的感染效果;常规培养基+Polybrene组(B组),观察Polybrene是否可以提升感染效果;ENi.S.组(C组),观察用ENi.S.替代常规培养基时病毒对细胞的感染效果;ENi.S.+Polybrene组(D组),观察Polybrene和ENi.S.条件下病毒对细胞感染效果;常规培养基+阴性对照病毒(E组);Control组,监控实验过程中细胞生长是否正常(表2)。(2)感染:接种细胞,用完全培养基制备2ml密度3~5×104个/ml的细胞悬液,取100μl/孔加入96孔板中,共15孔,其中3孔作为Control组,继续培养;第2d用ENi.s将慢病毒依次稀释成1×108 TU/ml(MOI=100)、1×107 TU/ml (MOI=10)、1×106TU/ml (MOI=1),各50μl;继而用ENi.S将Polybrene稀释成50μg/ml,共200μl,标记为P(E);用常规培养基将Polybrene稀释成50μg/ml,共200μl,标记为P(M);吸掉上清液,并按照表2向各孔中加入相应体积的溶液,混匀,继续培养;感染后12h换回常规培养基,过程中观察细胞形态。(3)感染效果检测:第5d(感染约72h后)荧光表达丰度较高时,用显微镜观察感染效果。感染效率80%左右,且细胞生长良好的组所对应的感染条件和MOI即可以作为后续感染实验的依据。(4)筛选:在6孔板中采用LV-FKN-RNAi感染HK-2细胞,按照感染预实验的最佳感染条件及MOI,在完成感染72h后加入终浓度8μg/ml的Puromycin对细胞进行筛选,3d后减少Puromycin的浓度至0.5μg/ml并维持此浓度培养1周,获得HK-2/LV-FKN-RNAi细胞株,通过Western blot验证结果。
| 图表编号 | XD0060287100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.20 |
| 作者 | 尤燕舞、付冬冬、王俊杰、Soulixay Senouthai |
| 绘制单位 | 右江民族医学院附属医院肾内科、右江民族医学院附属医院肾内科、右江民族医学院附属医院肾内科、右江民族医学院附属医院肾内科 |
| 更多格式 | 高清、无水印(增值服务) |





