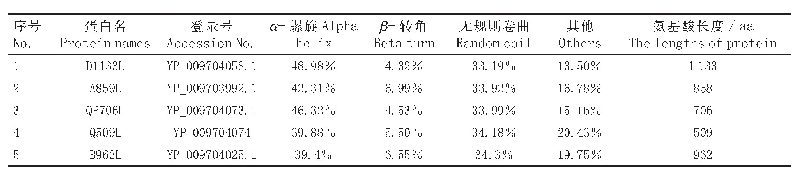
《表1 蛋白质二级结构构象及L-乳酸脱氢酶二级结构经SELCON软件定量分析结果》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《硫化氢信号分子与L-乳酸脱氢酶蛋白相互作用机制的研究》
如图4A所示,PS在~300 nm和~370 nm处有两个吸收峰为硫烷硫特征峰,Na HS在氧存在的条件下可以自动氧化形成聚硫(PS,Sn,n=2~8),并存在系列平衡[8]。因此,Na HS在~300 nm和~370 nm也存在两个吸收峰,同样Na2S溶液在300 nm处也有微弱的吸收峰,说明Na HS和Na2S溶液中有不同含量的硫烷硫。如图4B所示,PS组的CD图中,192 nm吸收值下降,222 nm和208nm处吸收值上升,这是由于PS含有最多的硫烷硫而具有更强的半胱氨酸巯基衍生能力。将CD图谱利用SELCON软件进行定量分析(表1),表明未经处理的L-LDH的α-螺旋结构含量最高(61.7%),β-折叠结构含量最低(3.90%),而PS处理的L-LDH的α-螺旋结构含量最低(23.7%),β-折叠结构含量最高(22.5%),再次揭示PS具有最强的半胱氨酸巯基作用力,引起蛋白质二级结构的改变。
| 图表编号 | XD0018746600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.07.01 |
| 作者 | 朱艳雯、刘玲、孙玮洁、颜廷才、檀德宏、张瑶、白冰 |
| 绘制单位 | 沈阳农业大学食品学院、沈阳农业大学食品学院、沈阳农业大学食品学院、沈阳农业大学食品学院、沈阳农业大学食品学院、沈阳师范大学美术与设计学院、沈阳农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |