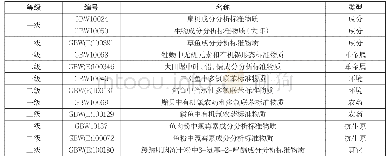
《表3 EUA产品、EIND产品、IND产品与已上市产品的相关标准比较》
表3详细地对比了EUA产品、EIND产品和一般情况下IND产品和已上市药品的相关标准[10]。EUA和EIND都是在紧急情况下的授权或批准,但两者在适用情形和使用范围上有明显区分。其中EUA是在实际的或潜在的紧急状态下对未获批准的医药产品的使用及已获批准产品的未获批准用途的授权,而EIND主要的适用情形主要为有严重疾病或立即危及生命的单一病人。因此,在紧急状态下,如疾病爆发时,EUA和EIND会在不同适用范围下对疫情的爆发有所缓解。而在正常状态下,单一病人同样可以通过EIND授权而获益。对于处方药安全报告的要求、知情同意的签署与否以及机构审查委员会的申请时限,EUA会有更宽泛的条件,而EIND则需要遵守基本的IND法规要求[10]。
| 图表编号 | XD00177547700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.25 |
| 作者 | 陈谨、徐然、赵东、杜涛 |
| 绘制单位 | 汉佛莱医药顾问有限公司、汉佛莱医药顾问有限公司、汉佛莱医药顾问有限公司、汉佛莱医药顾问有限公司 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式