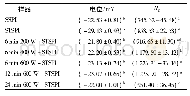
《表1 SPI、HSPI和HSPI(pH 5.9)的粒径、PDI以及表面疏水性》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《酸热诱导大豆分离蛋白纳米颗粒形成及其荷载姜黄素的特性》
实验首先利用DLS探究了pH 7.0及pH 5.9条件下加热对蛋白粒径及PDI的影响。如表1所示,SPI虽然平均粒径小(<80 nm),但是粒径分布不均匀(PDI>0.5),与相关报道一致。热作用使得SPI发生热变性形成聚集体,显著增加其平均粒径,但是同时增加其分散均一性。这是由于热处理引起了蛋白构象部分去折叠而诱导聚集,同时过程中形成了更多的二硫键使得颗粒相对稳定均一[27]。其中,经pH 5.9加热得到的样品HSPI(pH 5.9)因加热后回调至pH 7.0过程中吸水溶胀导致粒径增大[24];而加热后暴露出来的α’-、α-亚基具有延伸区域,已被证明可以抑制SPI的聚集,所以使颗粒能够维持均一[28]。进一步通过ANS-法测定3个蛋白样品的表面疏水性,结果表明,热处理可显著增加蛋白表面疏水性(P<0.05),可能与热变性会引起其结构的伸展及表面修饰有关。其中,pH 5.9条件下加热蛋白可使巯基转变成二硫键[24],而二硫键的周围常聚集着疏水性氨基酸,这使得HSPI(pH 5.9)的表面疏水性最高。
| 图表编号 | XD00171123200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.25 |
| 作者 | 袁丹、赵谋明、张思锐、黄燚、周非白 |
| 绘制单位 | 华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院、华南理工大学食品科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |