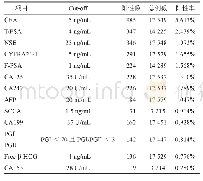
《表1 SERS技术在蛋白质类肿瘤标志物检测中的应用》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《表面增强拉曼光谱技术在肿瘤标志物检测中的研究进展》
蛋白质是生命有机体中至关重要的生物大分子之一,是能量存储、代谢和细胞功能调节等生命活动的主要承担者.而异常表达的蛋白质类TM通常出现在肿瘤的早期或晚期阶段,与多种疾病相关[9].因此,对其进行灵敏、准确且特异地量化分析在人类生命健康领域具有重要意义.目前,SERS技术在其检测中的应用,主要以抗原-抗体间的免疫反应为基础.首先,需制备具有高增强、高均一性等优点的SERS基底,包括基于贵金属的纳米颗粒、纳米阵列、石墨烯材料以及合金复合结构等[10],修饰有靶抗体的SERS基底作为捕获元件.然后,多数贵金属纳米材料与拉曼探针分子(Raman reporters)、识别抗体相结合,作为SERS标签(SERS tags)[11],以提供更显著的拉曼信号.当存在TM时,检测体系会形成夹心结构,拉近SERS基底与SERS标签之间的距离,产生“热点”(hot spots)效应,SERS增强因子可高达1012~1015倍[12],实现超灵敏的定量分析.Yang等人[13]提出了一种超灵敏的SERS免疫测定法,其原理如下(图1(a)):将甲胎蛋白(alpha-fetoprotein,AFP)抗体包被在96孔板上,以捕获AFP.通过免疫反应与碱性磷酸酶标记的AFP抗体形成夹心结构,利用酶诱导沉积反应,即酶使底物(L-抗坏血酸-2-磷酸三钠盐)去磷酸化形成维生素C,将Ag+还原成Ag0并包覆在金纳米颗粒(Au nanoparticles,Au NPs)表面.增强SERS信号,线性范围为0.5~100 pg/mL,检出限为0.081 pg/mL.该方法测定临床患者血清样品中的AFP含量与化学发光免疫法相比具有良好的一致性.Li等人[14]制备了一种新型SERS基底:银纳米颗粒(Ag nanoparticles,Ag NPs)包覆的SiO2光子晶体珠(SPCBs),如图1(b)所示,SiO2纳米颗粒通过自组装形成单分散、尺寸可控制的SPCBs,利用微流控装置使Ag NPs原位沉积在SPCBs上,即可得到AgSPCBs.通过改变SiO2纳米颗粒的直径,可获得具有不同反射峰位置的SPCBs,将不同Ag-SPCBs的反射峰作为编码元素,并修饰有不同抗体(antibody/Ag-SPCBs)存在目标物时,其可与SERS信号放大探针(4-MBA antibody/Ag NPs)形成夹心结构,在单个检测管中可同时检测AFP和癌胚抗原(carcinoembryonic antigen CEA),其线性范围分别为1×10-4~1×103、1×10-5~1×103ng/mL,检出限分别为7.2×10-5、6.6×10-6ng/mL Li等人[15]研发了一种基于SERS纳米标签(Ag@4-MBA@SiO2)的光纤生物传感器,首次原位免疫测定了未处理全血中的AFP,线性范围为50~500 ng/mL,检出限为17 ng/mL.此外,还成功用于体内和原位动态观察Wistar大鼠全血中的AFP,初步结果表明,该方法在体内实验中具有良好的应用价值.随着SERS技术的发展其被广泛应用于胚胎抗原、糖蛋白、受体蛋白等蛋白类TM的灵敏检测分析中,如表1所示.
| 图表编号 | XD00165368800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.30 |
| 作者 | 刘厦、霍亚鹏、康维钧、高志贤 |
| 绘制单位 | 河北医科大学公共卫生学院、军事科学院军事医学研究院环境医学与作业医学研究所天津市环境与食品安全风险监控技术重点实验室、军事科学院军事医学研究院环境医学与作业医学研究所天津市环境与食品安全风险监控技术重点实验室、兰州大学公共卫生学院、河北医科大学公共卫生学院、军事科学院军事医学研究院环境医学与作业医学研究所天津市环境与食品安全风险监控技术重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |