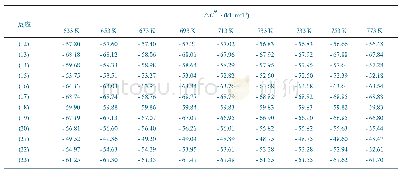
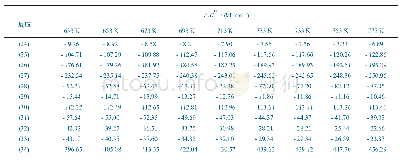
《表2 不同温度下的相对Gibbs自由能》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《p型掺杂剂Cp_2Mg在MOCVD气相中的反应机理研究》
注:Cp2Mg H和Mg H的Gibbs自由能值分别相对于Cp2Mg和Cp Mg H。
Cp2Mg中的第一个碳环氢解过程如反应G3~G8所示。Cp2Mg可能通过分子内分解反应(G4和G6)生成Mg,然后Mg原子可能与H自由基连续反应(G7和G8)生成MgH2。Cp2Mg也可能发生氢解反应G3和G5生成CpMg。上文已提到碳环Cp和Mg都有可能受到H自由基的攻击形成不同的加合物。Cp2Mg中的Mg受到H自由基的攻击会生成Cp2MgH,Cp2Mg和Cp2MgH的自由能列在表2中。发现在所有计算温度下Cp2MgH的自由能相对于Cp2Mg都是增大的,因此从热力学角度分析Cp2MgH不可能形成。所以,Cp2Mg与H自由基的反应产物为(CpH)CpMg。同样地,CpMgH消去Cp形成MgH的反应在理论上也不可能发生。
| 图表编号 | XD00159109500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.01 |
| 作者 | 张红、唐留 |
| 绘制单位 | 江苏大学能源与动力工程学院、江苏大学能源与动力工程学院 |
| 更多格式 | 高清、无水印(增值服务) |