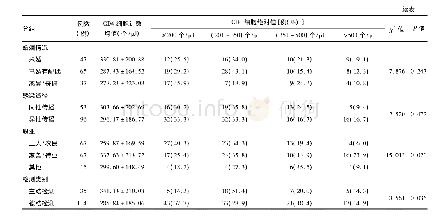
《表1 CD4 CTLs在不同类型的HIV患者中的表型及功能》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《CD4~+细胞毒性T细胞在临床HIV感染中的研究进展》
目前CD4 CTLs相关的研究主要是HIV感染的临床病例观察,尚无临床试验开展。最近越来越多的研究表明,HIV特异性CD4+T细胞在控制HIV复制中可能起关键作用[24-26],尤其在HIV特异性CD8+T细胞应答效率较低的情况下[27]。在HIV-1感染的初期,效应性CD4+T细胞的出现,不仅与急性期病毒载量的变化曲线相关,并且与早期病毒载量的最低值相关,表明它参与了病毒的早期控制[7,28]。许多研究团队针对HIV感染的不同阶段进行了研究,在早期的研究者中,Appay等[29]检测到HIV-1感染初期的患者体内有大量表达穿孔素、Gzm A、GMP-17/TIA-1的CD4+T细胞,在慢性感染期会升至更高水平。Johnson等[28]发现在HIV-1感染的疾病早期(primary HIV-1 infection,PHI)的HIV特异性CD107a+CD4+T细胞中,CD107a+IFN-γ+CD4+T细胞与HIV特异性CD8 CTLs共享转录谱,包括GzmA、B、K和穿孔素的表达,最重要的是HIV特异性CD107a+CD4+T细胞表现出与HIV特异性CD8 CTLs类似的杀伤活性[28]。除此之外,Soghoian等[27]对PHI的未治疗个体进行了纵向研究,发现在感染12个月内病毒复制得到控制的个体与病毒未得到控制的个体相比,HIV特异性CD4+T细胞显著扩增。与非控制者相比,病毒控制者(即长期无进展者)在Gag特异性CD4+T细胞上具有更高的脱颗粒标记CD107a的表达,并且在基线期时有Gzm A+HIV特异性CD4+T细胞应答[7,27],同样的现象在猿猴免疫缺陷病毒(simian immunodeficiency virus,SIV)动物感染模型中也得到验证,在删除了CD8+T细胞的猕猴中,CD4 CTLs能够控制SIV的复制[30]。Sacha等[31]发现,在精英控制者恒河猴体内用抗体去除CD8+T细胞后,可重新建立Gag和Nef特异性的CD4+T细胞应答实现对病毒的控制。总之,以上这些研究结果肯定了CD4 CTLs在控制HIV复制和延缓疾病进展方面的作用,详情见表1。
| 图表编号 | XD0012293700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2018.12.30 |
| 作者 | 李静、周明菊、张和倩、宋锦文、张超、王福生 |
| 绘制单位 | 蚌埠医学院临床医学系、中国人民解放军总医院第五医学中心感染性疾病诊疗与研究中心、中国人民解放军总医院第五医学中心感染性疾病诊疗与研究中心、中国人民解放军总医院第五医学中心感染性疾病诊疗与研究中心、中国人民解放军总医院第五医学中心感染性疾病诊疗与研究中心、蚌埠医学院临床医学系、中国人民解放军总医院第五医学中心感染性疾病诊疗与研究中心 |
| 更多格式 | 高清、无水印(增值服务) |