《表1 计算模型各参数及氮气(3)在丙酮(1)和氯仿(2)混合物中的计算溶解度与文献值偏差》
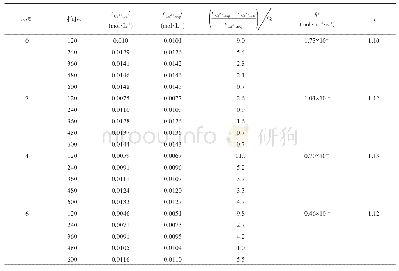
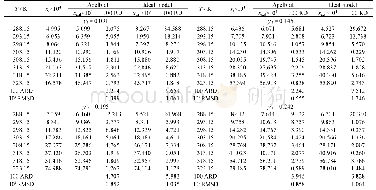
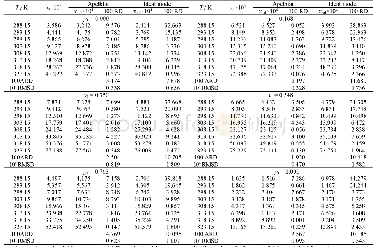
利用上述计算模型,可以得到在25℃和0.101325 MPa下,氮气在丙酮和氯仿混合物的溶解度,如图2和表1所示;图中b取K11=0.083、K22=0.054、K12=1.80,c取K11=0、K22=0、K12=1.30。Nitta等[28]报道了氮气在这二元混合物中的溶解度。当K11=0.083和K22=0.054,计算值与实验值的标准偏差为6.08%。从第二维里系数得到的缔合常数,其偏差较大;然而,目前尚无由NMR光谱实验数据得到的K22。当K11=0.083和K22=0.16,计算值与实验值的标准偏差为5.45%。当K11=K22=0.16,计算值与实验值的标准偏差为4.74%。Nitta等[28]并没有报道其实验偏差。据实验室气体溶解度测量的经验表明,通常气体溶解度的不确定为2%~5%。因此,假设实验数据H3,1和H3,2的偏差为-5%,其偏差为3.35%,如图3所示,图中曲线b K11=0.083、K22=0.054、K12=1.80、α12=9.0 J·cm-3。当忽略缔合作用(K11=K22=0),偏差为8.29%。
| 图表编号 | XD00118090900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.01 |
| 作者 | 杨富鑫、王晓坡、陈强、谭厚章 |
| 绘制单位 | 西安交通大学热流科学与工程教育部重点实验室、西安交通大学热流科学与工程教育部重点实验室、航天低温推进剂技术国家重点实验室、西安交通大学热流科学与工程教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式