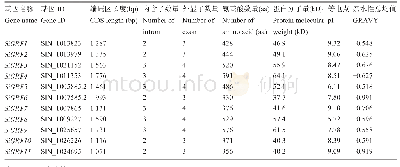
《表1 小分子热休克蛋白家族》
热休克蛋白是指生物体遭受外界高于其正常生长温度或剧烈震动时,新合成或过表达的一类保护机体自身的蛋白质,又称为胁迫蛋白。最早由遗传学家Ritossa[10]在1962年研究果蝇唾液腺时发现。根据单聚体相对分子质量大小和同源程度不同,可将热休克蛋白分为sHSPs,HSP 60,HSP 70,HSP 90及HSP110五大家族[11]。s HSPs是热休克蛋白的亚单位之一,相对分子质量在12 000~43 000之间,和其他热休克蛋白相比,该类蛋白不需要ATP即能发挥作用。目前已在哺乳动物中发现了11种s HSPs,且在不同组织中表达不同(表1)[4]。Taylor等[12]依据其在组织中的表达把sHSPs分为两类,一类是在所有组织中均表达;另一类是只在特定组织中表达。sHSPs作为一种重要的分子伴侣蛋白,结构上高度保守,在氨基酸序列C末端具有一段由80~100个氨基酸残基组成特定区域,因与αβ-晶体蛋白具有很高的同源性,所以也称为αβ-晶体蛋白区域[13]。除了一个灵活的C端,sHSPs还有一个连接着一个保守序列区域WDPF的N端[14]。sHSPs在体内以高度有序的寡聚体形式存在,其寡聚体的结构和组成均取决于每个小分子热休克蛋白单体的a-晶体结构以及C端和N端的长度和结构。受到应激反应时,s HSPs会发生解离或聚合,可形成相对分子质量达到2×105~8×105的低聚体复合物,从而发挥其生物学功能。
| 图表编号 | XD00107309200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.01 |
| 作者 | 黄峰、丁振江、孙红霞、张春江、张良、张泓 |
| 绘制单位 | 中国农业科学院农产品加工研究所(北京)、中国农业科学院合肥食品营养与健康创新研究院、中国农业科学院农产品加工研究所(哈尔滨)、中国农业科学院农产品加工研究所(北京)、中国农业科学院农产品加工研究所(北京)、中国农业科学院农产品加工研究所(北京)、中国农业科学院合肥食品营养与健康创新研究院、中国农业科学院农产品加工研究所(哈尔滨)、中国农业科学院农产品加工研究所(北京)、中国农业科学院合肥食品营养与健康创新研究院、中国农业科学院农产品加工研究所(哈尔滨)、中国农业科学院农产品加工研究所(北京)、中国农业科学 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式