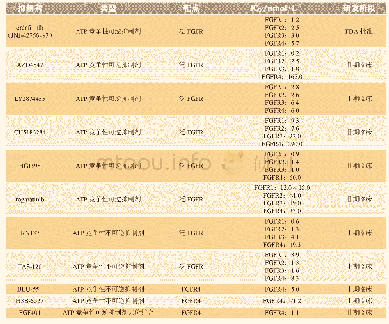
《表1 EGFR小分子抑制剂研究近况》
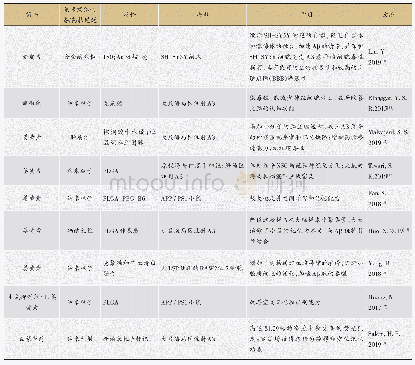
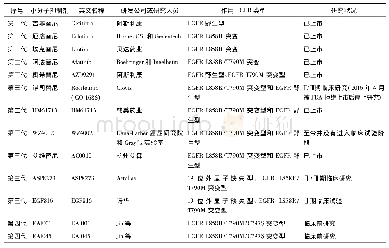
在使用EGFR抑制剂9~13个月后,患者会出现不同程度的耐药,这些小分子抑制剂所涉及的耐药机制十分复杂,有获得性耐药、旁路信号突变,以及下游信号的异常,都可能造成小分子抑制剂的疗效降低,其中最主要的是使用抑制剂后所产生的获得性耐药[21]。如图1所示,整个EGFR激酶结构域由外显子18~24等6个外显子编码,突变主要集中在外显子18~21,其中19号和21号外显子突变占总突变的90%[22]。20号外显子上790号位点上的氨基酸残基由苏氨酸(T)突变为半胱氨酸(M),是第一代EGFR出现耐药的主要原因。苏氨酸(分子量119.12)被半胱氨酸(分子量149.21)取代,引起酪氨酸激酶域空间构象改变,影响其与TKI的结合,极大地减弱了EGFR-TKI与激酶域之间氢键的亲和力[23-24]。如表1所示,第二代EGFR小分子抑制剂以克服T790M突变为目的研发,虽然临床前研究证明对T790M突变有较好的抑制效果,但缺乏对野生型EGFR的选择性,导致必须使用较高剂量药物才能达到治疗效果,而产生患者难以接受的毒副作用。基于以上原因,不得不研发新的小分子抑制剂。第三代抑制剂对EGFR野生型和T790M突变型都有较好的选择性[25],避免了由于选择性差而产生的一系列副作用,然而在服用第三代抑制剂数月后,也不可避免的出现了新的耐药情况,其中最为常见的是C797S突变。针对这一突变,研究者们又研究开发出第四代的EGFR小分子抑制剂,对EGFR的T790M及C797S突变型都有较好的抑制活性。
| 图表编号 | XD00106176800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.01 |
| 作者 | 李文、陈洁、胡伟男、漆亚云、付毅红、刘佳敏、王贞超、欧阳贵平 |
| 绘制单位 | 贵州大学药学院、贵州大学药学院、贵州大学药学院、贵州大学药学院、贵州大学药学院、贵州大学药学院、贵州大学药学院、贵州医科大学药用植物功效与利用国家重点实验室、贵州省合成药物工程实验室、贵州大学药学院、贵州省合成药物工程实验室、贵州大学精细化工研究开发中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式