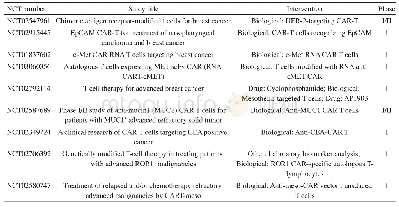
《表3 基于CAR-T的临床实验方案》
嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)疗法简称CAR-T疗法,是近年来广受关注的新兴疗法之一。嵌合抗原受体(CAR)是CAR-T的核心部件,赋予T细胞以HLA非依赖的方式识别肿瘤抗原的能力。目标抗原的选择对于CAR的特异性、有效性以及基因改造T细胞自身的安全性来讲都是关键因素[38]。近来的研究表明,CAR-T疗法不仅在血液系统恶性肿瘤中取得了非凡成就,在非血液系统恶性肿瘤中也取得了众多阳性结果[39]。Beatty等[40]发现,利用间皮素特异性嵌合抗原受体mRNA编辑的T细胞可以在PDAC中产生抗肿瘤反应。Raj等[41]利用IV期PDAC患者来源的肿瘤在免疫缺陷小鼠上建立了PDX模型(patient-derived tumor xenograft,人源肿瘤异位移植模型),在注射靶向Her-2的CAR-T细胞后,荷瘤小鼠所荷肿瘤完全消失。Chen等[42]的相关研究表明,将CAR-T疗法与PD-1抗体联合或使用CAR-T细胞内源性表达PD-1抗体,可以进一步提升CAR-T的治疗效果。Sandin等[43]的相关研究表明,CTLA-4抑制剂在小鼠体内可以显著减少Tregs细胞的富集,因此将CTLA-4与CAR-T疗法联合具有良好的理论基础。DeSelm等[44]发现,在CAR-T治疗前,用诸如环磷酰胺(cyclophosphamide)和/或氟达拉滨(fludarabine)和(或)ICBs预处理,可以削弱PDAC患者体内Tregs细胞活性,提高CAR-T疗法的治疗效果。CAR-T疗法发展非常迅速,目前已有多项针对PDAC的CAR-T疗法进入临床(表3),但是,CAR-T疗法的发展也面临着脱靶等问题。理想的目标抗原是仅表达在肿瘤细胞表面的肿瘤特异性抗原,但针对PDAC的大多数抗原不具备肿瘤特异性。因此,CAR-T疗法想进一步取得突破必须发掘并证实更多PDAC肿瘤特异性抗原,以期减小CAR-T疗法对正常组织和器官的毒副作用。
| 图表编号 | XD00105853600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.01 |
| 作者 | 邹依地、黄承浩 |
| 绘制单位 | 厦门大学公共卫生学院分子疫苗学和分子诊断学国家重点实验室国家传染病诊断试剂与疫苗工程技术研究中心、厦门大学公共卫生学院分子疫苗学和分子诊断学国家重点实验室国家传染病诊断试剂与疫苗工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式